Hibridación#
A principios de los años 30 Pauling desarrolló una serie de modelos para moléculas orgánicas sencillas que pretendían cohesionar los conceptos de estructura geométrica con los de estructura electrónica. La idea principal es que los orbitales moleculares van a cambiar según sea la estructura de la molécula. En particular es clave el papel de los orbitales atómicos del átomo central del enlace, que en química orgánica es jugado, principalmente, por el átomo de carbono. Estas ideas, de enorme importancia en química, tienen un valor de tipo ilustrativo pero su aplicación, sin sentido crítico, puede dar lugar a errores conceptuales. Además hay que tener en cuenta que Pauling utilizó durante mucho tiempo la teoría de enlace valencia, basada en los orbitales localizados mientras que rechazó, durante gran parte de su carrera, el uso de la teoría de orbitales moleculares y, por tanto, hay que entender el uso de orbitales híbridos en el contexto de esa teoría alternativa.
Tipos de hibridación#
La idea central de Pauling es que los orbitales 2s y 2p pueden hibridarse (superponerse) para formar otros que están adaptados a la forma de la molécula. Esto es correcto si los niveles 2s y 2p tuvieran la misma energía pero, cuantos más electrones tiene un átomo, más separación hay entre los orbitales 2s y 2p y, por tanto, más difícil es que se produzcan están hibridaciones. Por otro lado, tal y como hemos discutido en la teoría de los orbitales moleculares, lo principal en el enlace es la interacción entre los orbitales en átomos diferentes, por lo que no tiene mucha importancia como se coloquen los electrones en uno sólo de los átomos sin tener en cuenta de lo que ocurre en los que rodean al átomo central.
Veamos ahora los diferentes tipos de hibridación que propuso Pauling.
Hibridación sp#
En casos de moléculas lineales, como BH\(_2\) en la Fig. 183 Pauling propuso que la mezcla del orbital 2s con el 2p\(_z\) daría lugar a dos orbitales equivalentes con distribución de probabilidad polarizada hacia un lado de la molécula, lo que favorecería el solape. Estos dos orbitales que mezclan al 50% orbitales 2s y 2p\(_z\) se denominan híbridos sp. En el caso de la hibridación sp, además, tenemos dos orbitales (2p\(_x\) y 2p\(_y\)) perpendicular al enlace y que pueden participar para llegar a formar un enlace triple.

Fig. 183 Ilustración de la formación de dos orbitales híbridos sp en la molécula BH\(_2\) lineal. Nótese la separación de los niveles 2s y 2p en el átomo de boro.#
Hibridación sp\(^2\)#
En el caso de moléculas lineales, como BH\(_3\) en la Fig. 184, la hibridación de los orbitales 2s, 2p\(_x\) y 2p\(_y\) puede dar lugar a 3 orbitales equivalentes polarizados en direcciones separadas por ángulos de 120\(^o\), es decir, formando un triángulo equilátero. En este caso el átomo central tiene un orbital 2p\(_z\) no hibridado que puede utilizar para formar un enlace doble o uno deslocalizado, como en el caso del benceno.
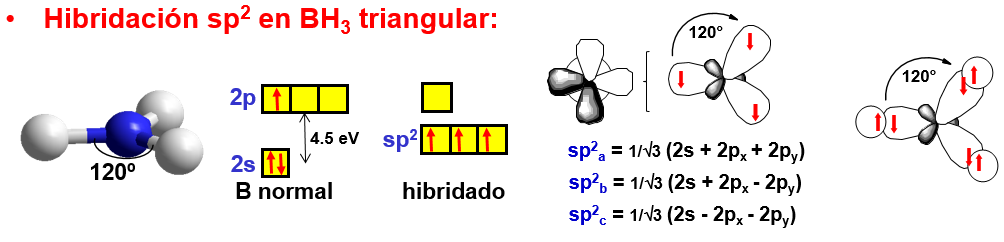
Fig. 184 Ilustración de la formación de dos orbitales híbridos sp\(^2\) en la molécula BH\(_3\) triangular. Nótese la separación de los niveles 2s y 2p en el átomo de boro.#
Hibridación sp\(^3\)#
En el caso de moléculas tetraédricas, como CH\(_4\) en la Fig. 185, la hibridación de los orbitales 2s, 2p\(_x\), 2p\(_y\) y 2p\(_z\) puede dar lugar a 4 orbitales equivalentes polarizados en direcciones separadas por ángulos de 109.4\(^o\), es decir, formando un tetraedro. En este caso los 4 enlaces serían equivalentes y sencillos.

Fig. 185 Ilustración de la formación de dos orbitales híbridos sp\(^3\) en la molécula CH\(_4\) tetraédrica. Nótese la separación de los niveles 2s y 2p en el átomo de carbono, que es mucho mayor que la correspondiente al boro en los casos anteriores y que haría imposible la hibridación a partes iguales entre el orbital 2s y los 2p.#
Es importante ver que según el modelo de hibridación habría 4 niveles degenerados o similar. El problema es que el modelo de Pauling funciona sólo en una teoría alternativa a la de los orbitales moleculares donde no hay energías a un electrón bien definidas, por lo que no pueden usarse para realizar predicciones sobre la espectroscopia que tendrían estas moléculas (que la teoría de orbitales moleculares sí hace y de forma correcta).
A pesar de sus muchas limitaciones las explicaciones basadas en los modelos de hibridación son muy comunes y, dado que no están basadas en una teoría rigurosa, existen muchos errores en las conclusiones que se llegan a través de ellos.
Ejemplos#
Agua#
En muchos casos se explica la forma de la molécula de agua, donde el ángulo entre los átomos de hidrógeno y el oxígeno es 104.5\(^o\) cercano, en cierta manera, al ángulo tetraédrico (109.4\(^o\)) como hibridación sp\(^3\), donde dos de los orbitales híbridos estarían llenos de dos electrones donados por el oxígeno (pares libres ya que no se comparten). Aún así cálculos de primeros principios no encuentran las concentraciones de carga asociadas a estos pares sueltos indicando que no es correcto aplicar el modelo sp\(^3\) a esta molécula.
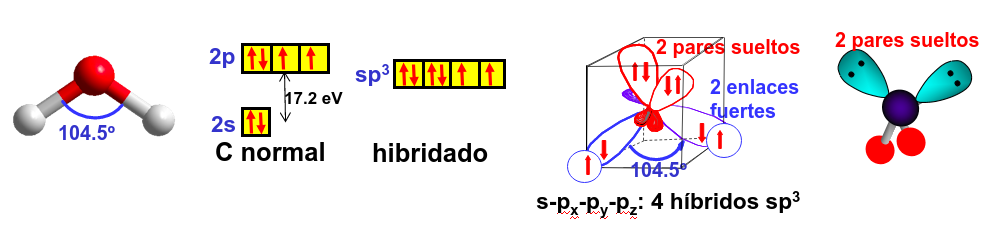
Fig. 186 El uso de la hibridación sp\(^3\) para explicar la forma de la molécula de agua implica que tendría que haber dos pares de electrones libres en la parte opuesta a los hidrógenos de la molécula. Dado que no se encuentran esto es un indicador del fallo del modelo.#
Amoníaco#
En el caso del amoníaco también se utiliza, en muchos casos, la hibridación sp\(^3\) para explicar su forma. En este caso el orbital híbrido en la dirección z no tendría un oxígeno y formaría un par suelto (libre) lo que haría que la molécula no tenga el ángulo característico del tetraedro.
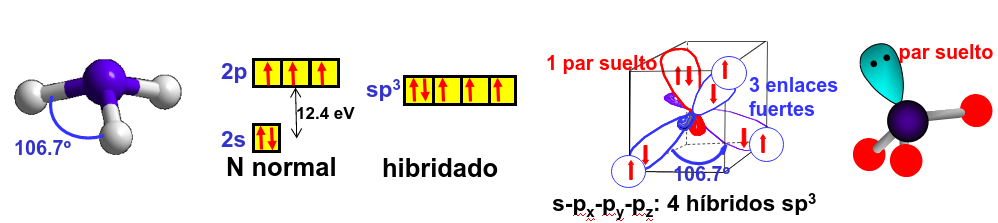
Fig. 187 El uso de la hibridación sp\(^3\) para explicar la forma de la molécula de amoníaco implica que tendría que haber up pares de electrones libres en la parte opuesta a los hidrógenos de la molécula.#
Etileno#
El caso de molécula con enlace doble más sencilla es el etileno (C\(_2\)H\(_4\)), que se ilustra en la Fig. 188.

Fig. 188 Ilustración de la molécula de eteno formada por dos átomos de carbono centrales, representados por esferas negras y 4 átomos de hidrógenos en los extremos de la molécula, representados por esferas blancas.#
En este caso la forma de la molécula se justifica mediante el uso de hibridación sp\(^2\) (ver Fig. 189 ) donde los orbitales híbridos se encargarían de formar los enlaces con los hidrógenos y un enlace sencillo de tipo \(\sigma\) entre los carbonos. Cada carbono tendría un electrón libre que iría al orbital p\(_z\). La interacción entre los orbitales 2p\(_z\) en carbonos opuestos daría lugar a un orbital enlazante de tipo \(\pi\) ocupado por estos dos electrones lo que formaría un enlace doble entre los carbonos.
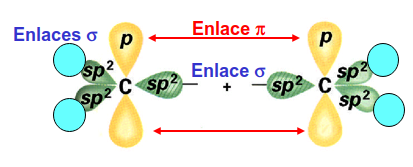
Fig. 189 Ilustración del enlace doble formado en eteno mediante la hibridación sp\(^2\) en los átomos de carbono, lo que permite formar 3 enlaces sencillos a cada uno. Los orbitales p\(_z\) perpendiculares al plano de la molécula permiten que se forme un enlace \(\pi\) entre los átomos de carbono.#
Este mismo nivel de enlace puede obtenerse, mediante un procedimiento semejante, desde la teoría de orbitales moleculares. El diagrama Fig. 190 muestra estos orbitales, tanto su energía como su forma. Puede verse que entre los orbitales ocupados hay varios enlazantes \(\sigma\) (\(2a_g\), \(1b_{2u}\), \(3a_g\)) y dos antienlazantes de este tipo (\(2b_{1u}\), \(1b_{3g}\)) además de uno enlazante \(\pi\) (\(1b_{3u}\)) dando lugar a un orden de enlace 2 (enlace doble).

Fig. 190 Diagrama de orbitales moleculares para el eteno junto a la forma de sus orbitales calculado mediante Hartree-Fock.#
En la Fig. 191 puede observarse como la interacción de los orbitales \(2p_z\) del carbono da lugar a un orbital enlazante de tipo \(\pi\) (1\(b_{3u}\)) y otro antienlazante (1\(b_{2g}\)).
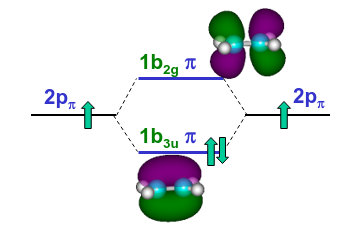
Fig. 191 Ilustración de la formación de orbitales con enlace tipo \(\pi\) mediante la interacción de los orbitales 2p del carbono perpendiculares al plano de la molécula (2\(p_z\)) en C\(_2\)H\(_4\).#
Benceno#
En el benceno, molécula hexagonal con 6 átomos de carbono, los orbitales \(p_z\), perpendiculares al plano de la molécula forman orbitales de enlace tipo \(\pi\) deslocalizados. En el caso de Pauling describía estas estructuras mediante la hibridación sp\(^2\) sobre cada uno de los carbonos. Desde el punto de vista de la teoría de los orbitales moleculares es posible adaptar por simetría a las irreps del grupo \(D_{6h}\) (ver Fig. 192 más abajo) para observar los orbitales moleculares formados.
Fig. 192 Tabla de caracteres del grupo \(D_{6h}\) asociadas a la geometría de mínima energía del benceno.#
En ese caso los orbitales y la energía que se obtiene para los orbitales \(\pi\) que están ocupados por 6 electrones (1 por átomo de carbono), produce máxima estabilización. Como puede comprobarse en la Fig. 193 estos orbitales de baja energía permiten el movimiento de los electrones por toda la molécula y, para los niveles de menor energía, tienen un número reducido de nodos.

Fig. 193 Niveles \(\pi\) deslocalizados en la molécula de benceno según la teoría de los orbitales moleculares.#
