Complejos de metales de transición#
Los metales de transición se caracterizan por llenar orbitales de tipo 3d, un nivel por debajo de la valencia que es la capa 4 y que, por lo tanto, son bastante compactos, lo que hace que solapen relativamente poco y que las interacciones electrón-electrón dentro de las mismas sean mayores que las que típicamente ocurren en orbitales de valencia.
Estas dos características hacen que los desdoblamientos de los niveles en estos sistemas sean pequeños respecto a los típicos en moléculas orgánicas (y se parezcan a los atómicos) y que en estos sistemas típicamente el magnetismo pueda aparecer (los espines de los electrones se colocan desapareados dando lugar a un momento magnético más alto).
Para describir estos sistemas normalmente se parte de los niveles atómicos donde los 5 niveles 3d estarían degenerados y se añade un potencial, llamado potencial cristalino, debido a los iones negativos que rodean al metal de transición. Este potencial desdoblará los niveles atómicos de forma consistente a la simetría con que se coloquen los primeros vecinos que se denominan ligandos. Esto está ilustrado en la Fig. 194. El ion de metal de transición central esta rodeado por 6 ligandos iguales formando un octaedro. El grupo puntual de la molécula es \(O_h\). Los 5 niveles 3d del metal se desdoblan en un doblete e\(_g\) (3d\(_{z^2}\) y 3d\(_{x^2-y^2}\)) y un triplete orbital (3d\(_{xy}\),3d\(_{xz}\), 3d\(_{yz}\)) característicos de la simetría cúbica.
Es importante notar que, contrariamente a lo que se indica en muchos libros el desdoblamiento cristalino (crystal splitting en inglés) se debe, mayoritariamente, al enlace covalente que forma un metal con sus ligandos. De hecho, al contrario que lo que ocurre con metales alcalinos o alcalinoterreos los metales de transición presentan electronegatividades relativamente altas lo que lleva a enlaces semicovalentes con sus ligandos.
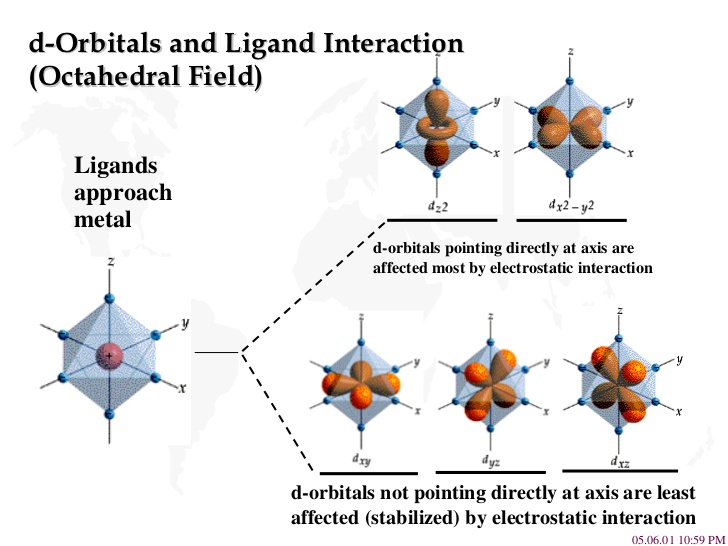
Fig. 194 Ilustración del desdoblamiento de los niveles 3d de un metal de transición cuando ocupa el centro de un complejo de metal de transición octaédrico en un doblete orbital \(e_g\) (con enlace \(\sigma\)) y un triplete orbital \(t_{2g}\) (con enlace \(\pi\)).#
