Estructura sólidos#
Ahora dejaremos las moléculas a un lado y veremos como se describe la geometría de los sólidos. Esto es más difícil de hacer que en las moléculas, ya que los sólidos contienen muchos más átomos. Seguidamente haremos una pequeña clasificación de los sólidos en amorfos y cristalinos y centraremos nuestra atención en estos últimos para el resto del curso.
Sólidos amorfos y sólidos cristalinos#
Cuando hablamos de fases condensadas (sólidos y líquidos) puede parecer, en ocasiones, que estamos describiendo dos estructuras disjuntas sin que exista nada intermedio. Realmente, existen varias etapas intermedias, como por ejemplo los vidrios, entre el líquido (un fluido desordenado) y los sólido perfectamente ordenados, como la sal común. Si atendemos al su orden interno existen dos tipos de sólidos principales, unos son desordenados llamados sólidos amorfos (ver Fig. 30) y otros ordenados, llamados sólidos cristalinos (ver Fig. 31).
Los sólidos amorfos tienen orden a corto alcance, lo que quiere decir que, si nos fijamos en la colocación de los enlaces alrededor de un cierto tipo de átomo, vamos a encontrar siempre patrones que son muy parecidos. Por ejemplo en los silicatos alrededor de cada átomo de silicio siempre se suelen encontrar 4 átomos de oxígeno formando, aproximadamente, un tetraedro. En cambio son desordenados a largo alcance, lo que quiere decir que a distancias mayores a dos o tres distancias de enlace no se puede predecir que átomos van a aparecer y en que disposición se van a encontrar. Ver una ilustración aquí.

Fig. 30 Los sólidos amorfos presentan una estructura ordenada a corto alcance y desordenada a largo alcance. Así, si nos fijamos en los círculos de pequeño radio, podemos ver la misma estructura rotada en diferentes direcciones, mientras que si nos desplazamos a un átomo en la circunferencia de radio más grande la colocación de los átomos a largo alcance es muy diferente a la del átomo central.#
Warning
Los cristales, aunque los llamemos así en castellano, no son sólidos cristalinos si no amorfos. Están formados por tetraedros de silicio y oxígeno cuyos enlaces pueden estar colocados en diferentes direcciones creando desorden a largo alcance.
Los sólidos cristalinos tienen orden a corto y a largo alcance, lo que significa que si conocemos la distribución de átomos alrededor de un átomo en particular podemos predecir la estructura alrededor de cualquier otro átomo del sólido incluso a muy largas distancias.
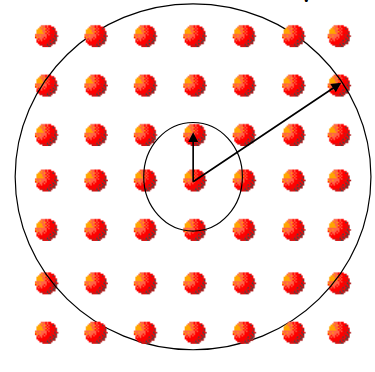
Fig. 31 Los sólidos cristalinos presentan una estructura ordenada tanto a corto como a largo alcance. Así, si nos fijamos en las distancias marcadas por el círculo de pequeño radio alrededor de cualquier átomo podemos ver siempre la misma estructura. Si, además, miramos que ocurre para los átomos colocados en una circunferencia de radio más grande alrededor de cualquier átomo también vemos que se repite el mismo patrón.#
Dada su ubicuidad en la naturaleza y sus muchísimas aplicaciones tecnológicas en este curso nos centraremos en lo que sigue en las propiedades de los sólidos cristalinos.
Sólidos reales y sólidos ideales#
Es muy importante darse cuenta de que la imagen que tenemos de un sólido cristalino (ver, por ejemplo, la Fig. 32) no es en absoluto como son estos materiales en la naturaleza. Los cristales normalmente nuclean alrededor de un defecto y, durante su crecimiento generan muchos otros defectos en su interior de forma espontánea. Ningún método de síntesis de cristales, por más lento que se produzca, va a producir un cristal ideal como el mostrado en la Fig. 32.

Fig. 32 Imagen idealizada de un sólido, que será la que utilicemos normalmente en el curso. Todos los átomos están en su posición sin ningún tipo de defecto en el patrón. Los sólidos reales NO son así, aunque para describir sus características nos basemos en este patrón que es aproximado.#
De hecho los defectos en los cristales, que como hemos dicho son inevitables, dan lugar a muchas propiedades interesantísimas. En la figura Fig. 33 se ilustran diferentes tipos de defectos que frecuentemente se encuentran en los cristales. Aunque la densidad de defectos mostrada en la figura es muy alta, es importante recordar que incluso en menor proporción los defectos pueden tener un gran efecto en las propiedades de los materiales. Por ejemplo, un cristal como la alúmina (Al\(_2\)O\(_3\)) que es transparente, duro y con un bajo precio, se suele utilizar en muchos productos industriales y construcción. Aún así cuando una pequeñísima parte de los átomos de aluminio se sustituyen por cromo (estos átomos entrar como impurezas) el material se denomina rubí que, como es bien sabido, tiene un color rojo intenso y alcanza altos precios.

Fig. 33 Imagen de un sólido cristalino ilustrando diferentes tipos de defectos que pueden estar presentes como, por ejemplo, impurezas (substitución de un átomo por otro), vacantes (falta un átomo), dislocaciones (falta un plano de átomos), frontera de granos (la conexión entre los bordes de regiones del sólido que han crecido siguiendo direcciones diferentes).#
En lo que sigue vamos a centrarnos en los sólidos cristalinos ideales y vamos a desarrollar como se describe su geometría. Esta rama de la física y la química se denomina la cristalografía.
