Introducción#
Históricamente el concepto más importante [1] para comprender la estructura de la materia es la existencia de los átomos y de como estos se agregan, como si de un juego de construcciones se tratara, para formar una casi infinita variedad de sustancias, cada una con sus propiedades particulares.
En este curso vamos a asumir que se ya conoce como describir los átomos y buscaremos extender este conocimiento para responder a tres cuestiones fundamentales:
¿En qué forma se agregan los átomos?
La respuesta a esta pregunta es bien conocida, los átomos se agregan formando moléculas y sólidos. En el aspecto en que nos centraremos en este curso es como, al formar estos materiales, los átomos se colocan en estructuras que tienen formas geométricas bien definidas. En el primer tema [Estructura geométrica] buscaremos describir formalmente estas estructuras y veremos como la simetría es muy útil para clasificar tanto moléculas como sólidos. En los siguientes temas [Red recíproca,Difracción rayos-X], profundizaremos en las consecuencias de un tipo de simetría, la periodicidad, en los sólidos cristalinos y como podemos usarla para realizar experimentos que nos permitan conocer cómo se colocan los átomos en su interior.
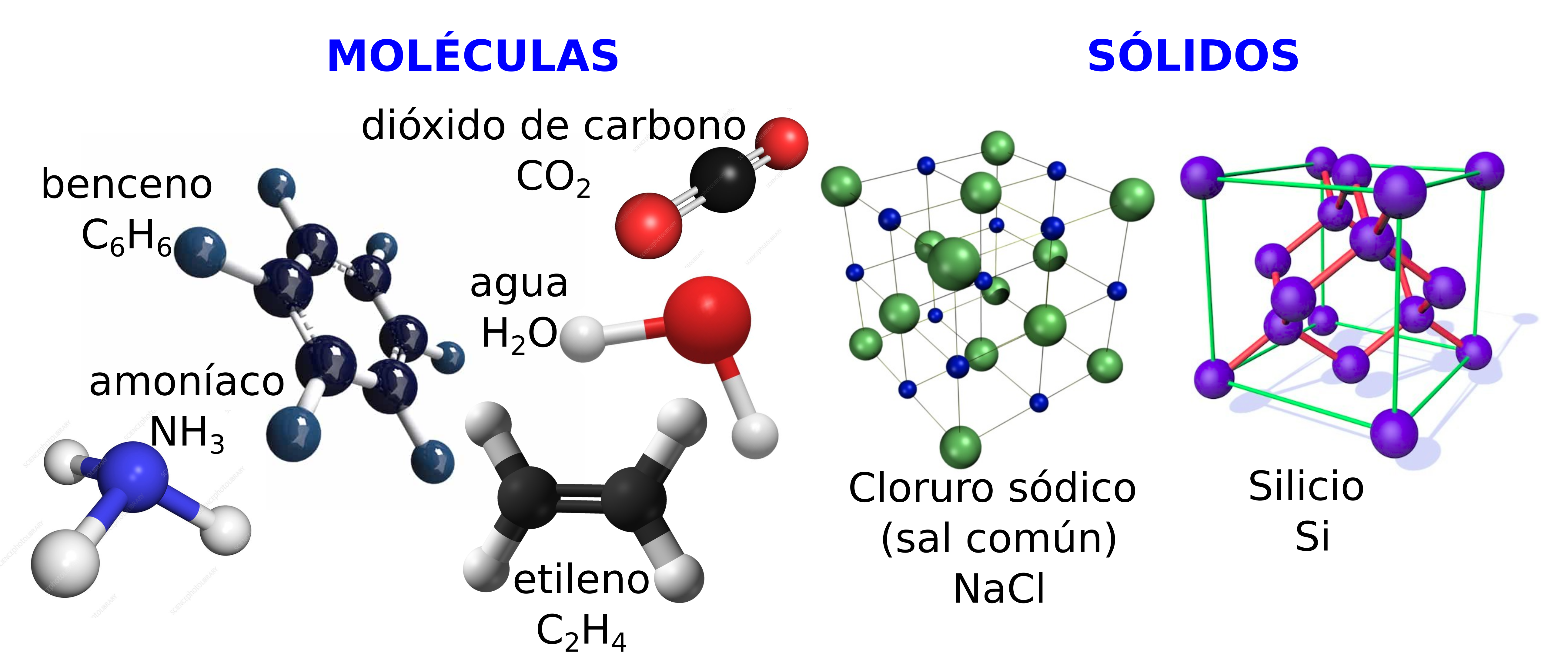
Fig. 1 Representación gráfica de varias moléculas sencillas de gran importancia, al igual que la estructura de un śolido iónico (cloruro sódico) y otro covalente (silicio) también muy importants desde el punto de vista fundamental y aplicado#
¿Por qué se agregan los átomos?
Así como en los primeros temas tan sólo describiremos las formas que se han observado experimentalmente para moléculas y sólidos, a partir del tema Estructura electrónica comenzaremos a discutir los motivos por los que los átomos pueden interaccionar entre sí formando enlaces químicos.
Prácticamente cualquier molécula, por pequeña que sea, contiene un número de partículas, los electrones y núcleos que forman los átomos, que hace que resolver las ecuaciones que describen el movimiento de las mismas exactamente sea imposible. Además, todas estas partículas son microscópicas con lo que las leyes de Newton no son aplicables y deberemos usar la mecánica cuántica, lo que complica aún más el problema.
Los fundamentos necesarios para describir el movimiento electrónico en moléculas y sólidos los veremos en el tema Estructura electrónica. Dada la dificultad matemática para aplicar toda esta teoría sobre, prácticamente, cualquier molécula, seguidamente veremos las aplicaciones de la Simetría lo que nos permitirá resolver analíticamente problemas que involucren moléculas relativamente sencillas. Toda esta teoría formal se aplicara en los temas sobre Moléculas diatómicas y Moléculas poliatómicas para entender los aspectos más importantes del enlace químico. Finalmente en el tema Fuerzas intermoleculares discutiremos como las moléculas también interaccionan entre sí para poder entender, por ejemplo, la existencia de gases, líquidos y sólidos.
¿Qué propiedades tienen los agregados de átomos?
El aspecto final del curso será estudiar como la estructura microscópica de la materia, la manera en que los átomos se colocan al formar moléculas y sólidos, determina las propiedades que podemos medir. En el tema sobre Espectroscopía discutiremos el principal medio que tenemos para investigar y conocer la materia, es decir, trataremos la interacción de la luz con la materia y como diferentes procesos físicos pueden observarse cuando se utiliza radiación de diferentes frecuencias. Por otro lado en el tema sobre Vibraciones en sólidos trataremos el enlace en sólidos y que tipo de medidas pueden emplearse para caracterizarlo.
Las fases de la materia#
En nuestra vida cotidiana la materia se suele presentar en tres formas usuales, aunque hay otras, que denominamos las fases de la materia. Estas son gas, líquido y sólido. Tanto el gas como el líquido son fluidos, es decir, no tienen forma definida y se adaptan al contenedor, mientras que los sólidos tienen formas definidas. La principal diferencia macroscópica de un gas y un líquido es que este último está condensado, es decir, tiene un volumen aproximadamente fijo, como los sólidos.
Desde un punto microscópico hemos indicado que podemos entender la materia haciendo uso de agregados de átomos que denominamos moléculas y sólidos. Las moléculas son agregados relativamente pequeños, aunque pueden contener miles de átomos. Formalmente, una molécula es la forma más pequeña en que un cierto compuesto mantiene sus propiedades y composición, es decir, la relación entre los diferentes átomos que lo forman.
Cuando las interacciones entre moléculas en una sustancia son suficientemente débiles (comparada con la energía térmica) las moléculas se encuentran muy lejos unas de otras y el sistema se comporta como un gas. Según las fuerzas entre ellas se van haciendo más grandes se llega a un punto donde el sistema transita a fase líquida, cuando las moléculas aún retienen cierta movilidad, y a un sólido cuando están fijas en ciertas posiciones, no permitiendo que el compuesto cambie de forma. De este modo un sólido, aunque realmente puede tratarse como una molécula muy grande con un número de átomos del orden del número de Avogadro (\(N_A\approx 10^{23}\)), se suele tratar como un sistema con un número infinito de átomos que tienen posiciones prácticamente fijas. Estas interacciones las trataremos en el tema de fuerzas intermoleculares.
Aunque un átomo es materia, en general podemos considerar que es la forma más sencilla de molécula en fase gaseosa.
Estructura molecular y mecánica cuántica#
Para describir físicamente una molécula deberemos resolver la ecuación de Schrödinger,
Aquí \(\hat{H}\) es el operador Hamiltoniano que describe energía del sistema y \(\Psi\) la función de onda de la molécula. Toda la información del sistema se encuentra contenida en \(\Psi\) que, por lo tanto, va a depender de las posiciones de las partículas que componen el sistema; estas son, por un lado, los electrones, cuya posición denotaremos con minúsculas e índices latinos, \(\vec{r}_i\), y, por otro, las de los núcleos que denotaremos con mayúsculas e índices griegos, \(\vec{R}_\alpha\). En lo este capítulo pasaremos a escribir este Hamiltoniano en detalle, por tanto fijando cuales son las interacciones más importantes entre las partículas que forman una molécula o sólido y resolveremos una importante cuestión conceptual que se plantea en el cuadro inferior.
Danger
La representación de las moléculas que hacemos, por ejemplo, en la Fig. 1 implica que una partícula cuántica, los núcleos de oxígeno e hidrógeno en la molécula del agua, están perfectamente localizados. Esta idea, que nos han enseñado desde que se empieza a estudiar conceptos básicos de química en el instituto, entra en conflicto directo con el principio de incertidumbre de Heisenberg, \(\Delta x \cdot \Delta p \geq \hbar/2\), una partícula cuántica no puede tener una posición perfectamente definida (es una onda) a menos que nos rindamos a que su momento (y, por tanto, su velocidad) esté completamente indeterminado, lo que no es una situación física.
De hecho, para poder hablar de estructura geométrica de moléculas y sólidos (¡el tema principal de este curso!), es necesario que pensemos en los átomos como objetos perfectamente localizados en un punto del espacio. El objetivo principal de este capítulo será, precisamente, explicar como es posible que podamos hablar de estructura molecular en mecánica cuántica y que será resuelto con la Aproximación adiabática.
