Estructura geométrica#
Introducción#
El tema anterior acabó con la aproximación adiabática, un resultado clave que nos permitió explicar por qué las moléculas y los sólidos presentan una geometría. En este tema vamos a describir qué tipo de formas muestran unos y otros sistemas, cómo definir cuantitativamente sus geometrías y usaremos la simetría como concepto clave para clasificar estas estructuras y comprender algunas de sus propiedades.
Importancia de la estructura geométrica#
Las propiedades de un sistema están determinadas en gran parte por su estructura. Como ya hemos visto el Hamiltoniano electrónico toma como parámetros la geometría nuclear donde se evalúa y, como veremos, esta geometría determina muchas importantes características de la función de onda y de todas las propiedades, que dependen de esta última. De hecho, una de las partes centrales de la química es el estudio de la geometría de las moléculas dado que esto determina como reaccionará.
Para visualizar, de forma sencilla, como esto puede ser tan importante, podemos observar la geometría de una pareja de moléculas en la Fig. 10. El oxígeno es simétrica respecto a su punto central lo que hace que no pueda formar un dipolo eléctrico. Mientras tanto, en la molécula de agua, que tiene una forma angular donde el oxígeno y el hidrógeno están cargados de forma opuesta (negativo/positivo), sí puede formar un dipolo. Esto hace, por ejemplo, que el agua sirva para disolver sólidos iónicos como la sal común, pero eso no lo podamos hacer, por ejemplo, con oxígeno líquido. De igual forma, esto determina como interaccionan con la luz, que podemos considerar como un campo eléctrico oscilante. La molécula de agua intentará orientarse en el sentido de este campo eléctrico mientras que la molécula de oxígeno no lo hará.
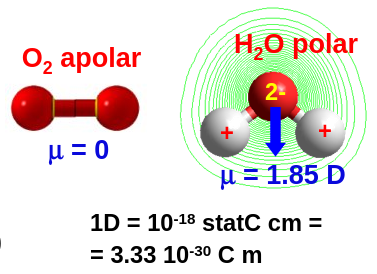
Fig. 10 Dependiendo de su estructura las moléculas tienen diferentes propiedades. Por ejemplo, la molécula de la izquierda, oxígeno molecular, no tiene dipolo eléctrico mientras que la de la derecha, el agua, es polar.#
Lo que se ha indicado más arriba es tan sólo uno de los muchos ejemplos que se pueden poner con la enorme correlación existente entre estructura y propiedades. Por ejemplo, en moléculas con forma de anillo, como el benceno (ver la Fig. 11) puede haber corrientes circulares que afectan a sus propiedades magnéticas y que, en química, caracterizan la aromaticidad.

Fig. 11 Estructura del benceno obtenida mediante una simulación de primeros principios. Consiste en dos hexágonos colocados concéntricamente, el más interno formado de átomos de carbono y el segundo de átomos de hidrógeno. Bajo la acción de un campo magnético los electrones pueden girar siguiendo el anillo, generando un campo magnético inducido y modificando las propiedades magnéticas de los compuestos donde aparecen.#
También podemos hablar como aquellas moléculas cuya forma no se puede superponer con la de su reflejo en el espejo (como nuestras manos) absorben, tan sólo, luz polarizada circularmente que giran en un sentido particular, mientras que su imagen especular (su isómero) absorbería la luz que gira en el otro sentido. Esta propiedad es llamada quiralidad (quiral viene de la palabra griega para manos) y la presentan moléculas muy importantes como la glucosa (los isómeros son la dextrosa y la levosa) o el ADN, cuya cadena en espiral determina el tipo de quiralidad.
Observación experimental de la estructura#
Aunque ya se ha indicado que la estructura de una molécula o un sólido es una de características más importantes y que determinan, en gran parte, las propiedades que puede tener un sistema lo que no se ha indicado, y que es de gran importancia, es como se observa. La, en gran medida, sorprendente respuesta es que la geometría en que se colocan los átomo en la materia es difícil de observar directamente. La separación típica entre átomos es típicamente de unos pocos Å lo que hace imposible la visualización de estas distancias mediante microscopios usuales. Hoy en día podemos visualizar moléculas directamente depositándolas sobre una superficie y utilizando, por ejemplo, microscopios de efecto túnel y fuerza atómica que fueron desarrollados en los años 80 del siglo XX (ver Fig. 12).

Fig. 12 Podemos observar la forma de moléculas depositadas sobre una superficie mediante microscopios de efecto túnel (STM, fila superior) o de fuerza atómica (AFM, fila intermedia). Del lado izquierdo al derecho se puede observar como la temperatura hace cambiar la forma de la molécula.#
Dada la importancia de conocer la geometría de las moléculas y los sólidos para determinar sus propiedades, ¿cómo pudieron validar la teoría cuántica que las explicaba en los años 30 del siglo pasado? Por un lado había multitud de pruebas indirectas, como la espectroscopia rotacional, que permite medir el momento de inercia de una molécula y, por tanto, ser capaz de estimar las distancias interatómicas. Por otro lado, en 1912 se había desarrollado la difracción de rayos-X lo que permitía conocer la estructura de sólidos cristalinos sencillos como la sal común (ver Fig. X-ray). Hoy en día esta técnica sigue siendo muy utilizada y, unida al análisis de los patrones mediante ordenadores, es capaz de encontrar la geometría incluso de complejas proteínas con miles de átomos como el ADN.

Fig. 13 Un espectro de difracción de rayos-X tanto para un monocristal (izquierda) como en polvo (derecha) nos permite deducir la estructura de un sólido con mucho detalle.#
Conocer como describir la estructura de una molécula o sólido es parte del lenguaje básico de físicos moleculares o de estado sólido, químicos, ingenieros de materiales o biólogos. Es por ello que este tema es central para tener el vocabulario necesario en cualquiera de estos campos.
Problemas y ejemplos#
Calcular la distancia típica entre átomos en la sal común (NaCl) sabiendo que su densidad es de 2.16 g/cm\(^3\).
