Fuerzas intermoleculares#
En los temas anteriores se ha discutido como los átomos y los electrones que contienen interaccionan electrostáticamente entre sí para formar las moléculas. En esos casos la clave estaba en como la interferencia entre orbitales en diferentes átomos producía niveles de baja energía que, al ocuparse, daban lugar al enlace químico.
En este tema vamos a ver, brevemente, que es lo que ocurre cuando moléculas, que en la mayoría de los casos tienen capa cerrada y, por lo tanto, no van a formar nuevos enlaces covalentes o iónicos, interaccionan entre sí. En particular, vamos a describir una serie de interacciones que, aún siendo electrostáticas, como en todos los casos vistos hasta ahora, son más débiles que la compartición o la donación/recepción de carga típicas del enlace interatómico. Estas interacciones dependen de los dipolos que se forman en las moléculas y son muy importantes para comprender el estado en que gran parte de la materia se encuentra (gas, líquido o sólido). Seguidamente se presenta un cuadro resumen de estas interacciones.
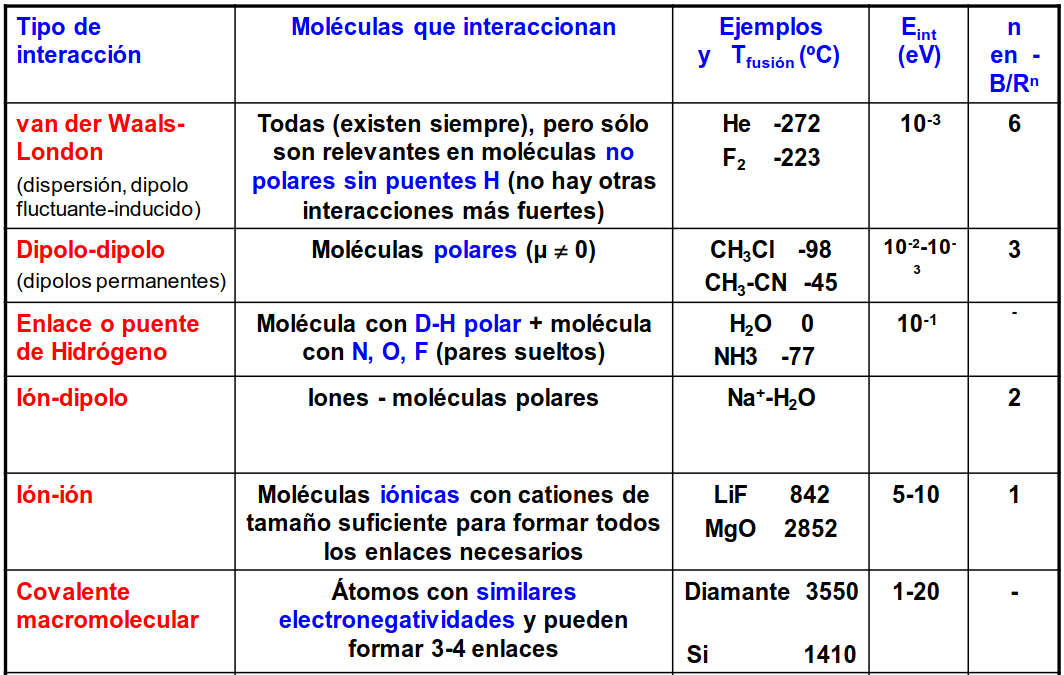
Fig. 195 Tabla ilustrando los diferentes tipos de fuerzas intermoleculares y las magnitudes típicas que presentan.#
Interacción dipolo-dipolo#
La mayoría de las moléculas son neutras, lo que anula sus interacciones electrostáticas a más largo alcance. Aún así, las moléculas no son puntuales y presentan una distribución de carga. El siguiente término, más allá de las cargas, en un desarrollo multipolar es el dipolo eléctrico. Por tanto, un razonamiento sencillo de tipo electrostático nos indica que es posible que si las moléculas presentan dipolos locales pueden interaccionar entre ellas. Experimentalmente es lo que se encuentra, siendo la interacción dipolo-dipolo de las más fuertes existente entre moléculas (ver Fig. 196).
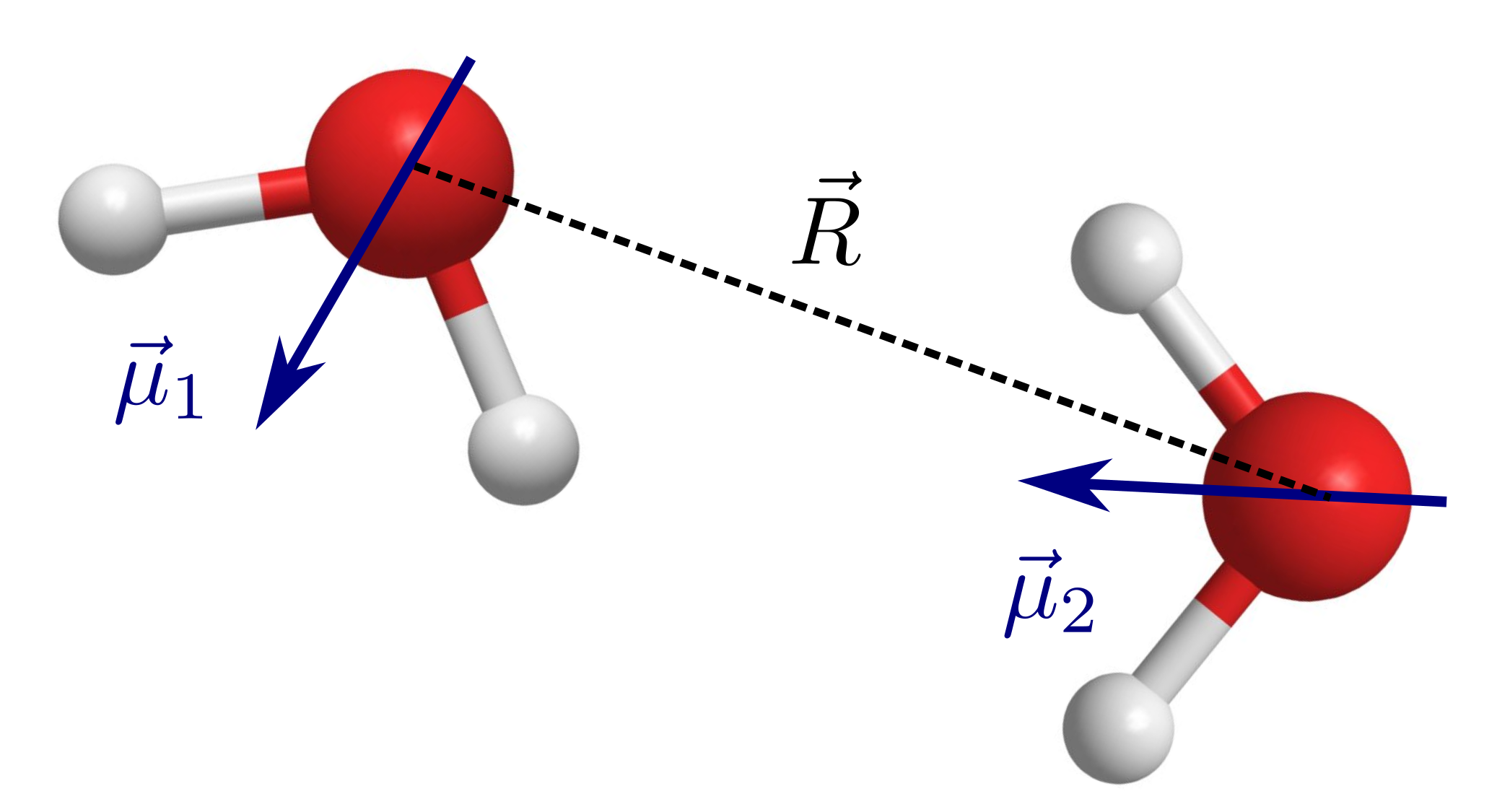
Fig. 196 Dos moléculas de agua, aunque son neutras, pueden interaccionar a largo alcance mediante los dipolos permanentes que tienen las moléculas.#
La energía entre dos dipolos, \(\vec{\mu}_1\), \(\vec{\mu}_2\), es la siguiente:
Puede comprobarse que este efecto es muy importante, de hecho una de las reglas de las disoluciones en química tiene que ver con que las moléculas polares (es decir, con un dipolo) pueden disolver a otras moléculas polares (debido a que interaccionan fuerte) mientras que no pueden hacerlo con moléculas no polares (con las que no interaccionan fuerte). La interacción es de relativo largo alcance siendo su decaimiento proporcional a \(R^{-3}\).
Interacción de Van der Walls#
Aunque una molécula no tenga un dipolo permanente su nube electrónica puede fluctuar y crear dipolos instantáneos (ver Fig. 197).

Fig. 197 La nube electrónica de un átomo o molécula oscila en el tiempo formando dipolos instantáneos#
De hecho el dipolo instantáneo de una molécula genera un campo que puede inducir un dipolo en otra molécula. Este efecto depende de la polarizabilidad de la molécula que mide la facilidad con la que se forma un dipolo en la misma,
Por tanto, si dos moléculas no polares se acercan la una a la otra pueden inducirse dipolos instantáneos, tal y como se ilustra en la Fig. 198, aunque este efecto va a depender de la polarizabilidad de la molécula. El orden de magnitud de esta interacción es,
Como puede verse esta interacción será necesariamente débil y decae rápido (\(\approx R^{-6}\)) con la distancia.

Fig. 198 En la interacción de Van der Waals el dipolo instantáneo en una molécula permite polarizar otra molécula cercana creando una interacción entre ellas débil.#
Estas interacciones son claves para explicar la existencia de fases líquidas y sólidas en muchos sistemas donde la teoría de los orbitales moleculares indicaría que no hay ningún enlace. Algunos sistemas donde esto se produce se ilustran en la Fig. 199.
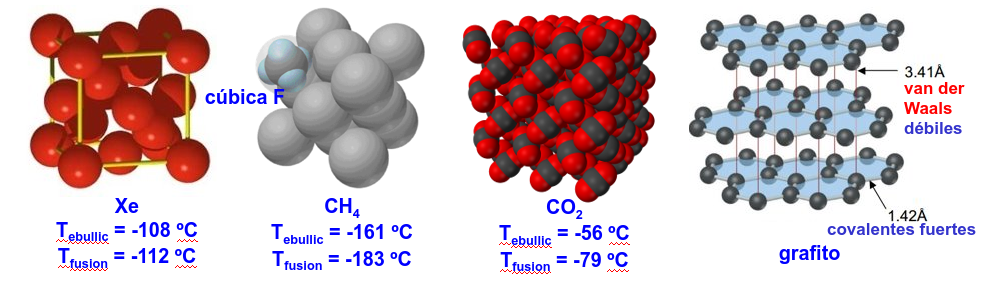
Fig. 199 Varios sistemas donde la interacción de Van der Waals resulta fundamental para explicar las interacciones intermoleculares y su influencia sobre la temperaturas de ebullición y fusión.#
Las interacciones de Van der Waals se incrementan con la polarizabilidad que viene, normalmente, asociada a átomos grandes donde los electrones no están fuertemente ligandos. Así, por ejemplo, en la serie de moléculas \(CX_4\) (X=F, Cl, Br, I) (ver Fig. 200) al cambiar el ligando por átomos cada vez más pesados (y con una nube electrónica más extensa) la polarizabilidad de la molécula crece y las interacciones de Van der Waals con ella, dando lugar a mayores temperaturas de fusión de los compuestos.

Fig. 200 El punto de fusión en las moléculas \(CX_4\) (X=F, Cl, Br, I) crece a lo largo de la serie debido a que los átomos más pesados son más polarizables lo que incrementa las interacciones de Van der Waals entre las moléculas.#
Por otro lado, a mayor superficie de contacto la temperatura de fusión/ebullición también crece. Esto es claro en el grafito, ilustrado en la Fig. 199 o en moléculas largas/planas (ver Fig. 201.
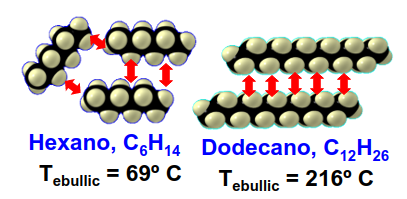
Fig. 201 En los hidrocarburos cuanto más larga es la cadena más fuerte es la interacción de Van der Waals entre sus moléculas. Por tanto, a mayor longitud mayor temperatura de ebullición/fusión.#
Puentes de hidrógeno#
Los puentes de hidrógeno son interacciones semi-covalentes que ocurren entre una molécula donante, donde un átomo de hidrógeno esta ligado a un elemento muy electronegativo (como N, O o F) y hay una molécula aceptora que posee un electrón libre (normalmente conteniendo N, que tiene 1 par libre, O que tiene 2 pares libres o F, que tiene 3 pares libres).
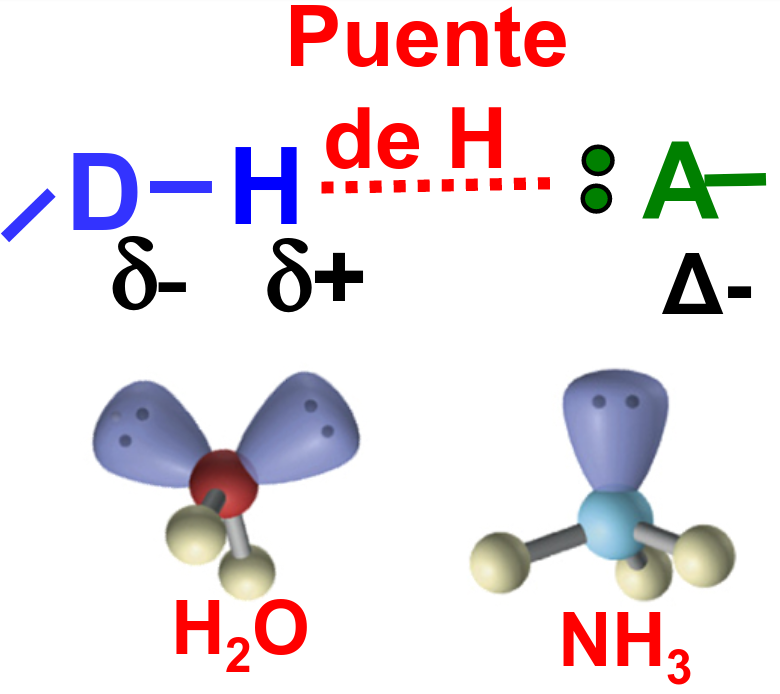
Fig. 202 Ilustración de pares libres que son la base para aceptar un hidrógeno en la formación de un puente de hidrógeno.#
Su efecto es muy importante en la temperatura de ebullición o fusión de algunos compuestos. En la Fig. 203 puede observarse que los hidruros de N (amoníaco), O (agua) y F tienen temperaturas de ebullición que no se corresponden con la tendencia de la gráfica. Esto es debido a la presencia de puentes de hidrógeno en el enlace intermolecular.
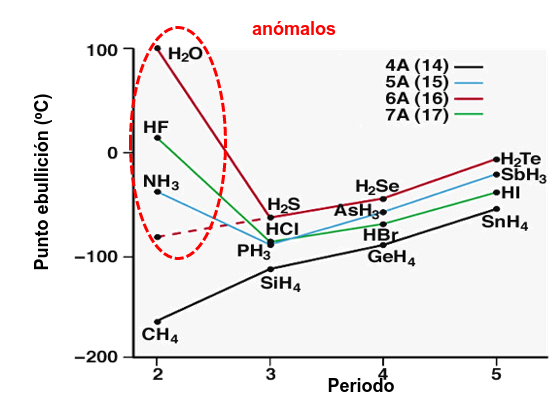
Fig. 203 Variación de la temperatura de ebullición dependiendo de átomo con el que enlaza el hidrógeno en algunos hidruros. Los elementos más electronegativos (N, O, F) presentan una tendencia anómala.#
En general lo que se puede observar, ver Fig. 204, es que el átomo de hidrógeno se aleja del átomo donante y se acerca al aceptor creando un enlace que puede ser bastante estable (véase la Tabla de fuerzas de enlace, Fig. 195) y que cambia la estructura del sistema molecular.
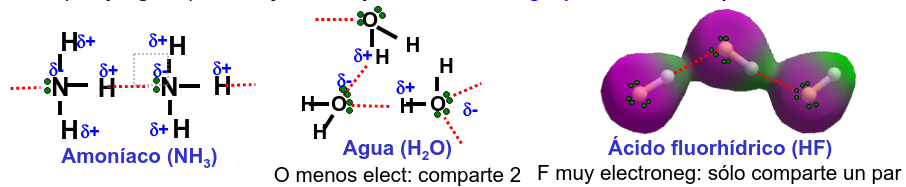
Fig. 204 Ilustración de la superficie de energía de la molécula de hidrógeno y sus niveles cuánticos calculados según la aproximación armónica.#
