Nociones básicas de enlace químico#
Definición del enlace químico#
La difinición precisa del enlace químico es difícil de enunciar debido a que hay muchas condiciones y fenómenos que tienen que ver con el mismo. La condición clave es que la energía de un agregado de átomos, una molécula, tiene que ser menor que la suma de las energías de los átomos individuales,
Esto significa que, según los átomos se vayan acercando unos a otros (ver Fig. 2) la energía debe de reducirse.
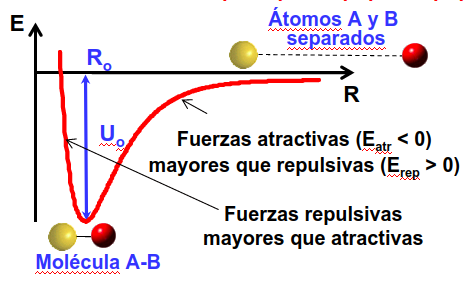
Fig. 2 Curva que ilustra el potencial interatómico típico. La energía potencial debe descender mientras dos átomos se acercan el uno al otro para que se forme una molécula. Esta tendrá una forma asociada al mínimo de este potencial que ocurre a una distancia \(R_0\) y produce una energía de enlace \(U_0\).#
Electronegatividad#
Como veremos en el tema de estructura electrónica una de las principales claves del enlace es como los átomos comparten y se ceden entre sí electrones. Por tanto, la magnitud que es clave para distinguir que tipo de enlace van a tener dos átomos entre sí y cual será su fuerza es la electronegatividad, \(\chi\). Esta mide cuanto tiene un elemento a atraer y retener a los electrones. La escala más usual es la de Pauling, en la tabla periódica de la Fig. 3, se da este valor como una escala de color. Esta propiedad crece hacia arriba y la derecha en la tabla periódica y el elemento más electronegativo es el fluor.
Cuando un elemento muy electronegativo se acerca a uno con mucho menor valor de esta propiedad tiende a capturar alguno de sus electrones dando lugar a un enlace iónico. Cuando dos elementos con similar electronegatividad dan lugar a un enlace este se suele decir covalente donde los electrones tienden a compartirse.
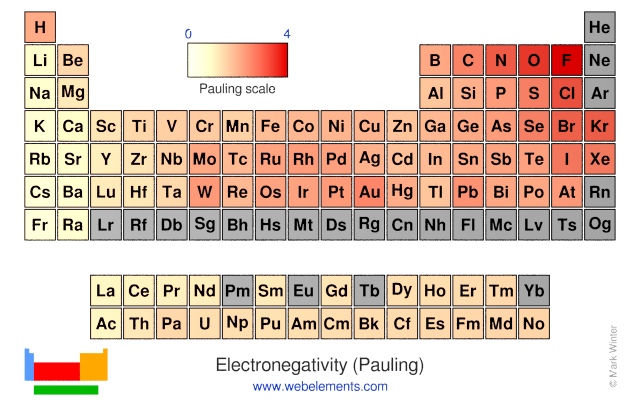
Fig. 3 Tabla periódica donde se da un valor a la electronegatividad de acuerdo al criterio de Pauling. En particular ese valor se muestra mediante una escala de color entre el blanco y el rojo oscuro.#
Modelo de Lewis#
El modelo de Lewis es el modelo más sencillo de enlace covalente. Se basa en ideas empíricas pero que reproducen, cualitativamente, varias tendencias importantes en el comportamiento de la fuerza del enlace en moléculas. Es también cierto que no está basado en una teoría rigurosa y que, por tanto, hay varios casos donde falla de forma muy evidente.
El modelo se basa en los siguientes principios:
La clave del enlace está en la compartición de pares de electrones entre los átomos.
Los átomos comparten electrones para adquirir una configuración de capa cerrado (8 electrones en los elementos de la fila II de la tabla periódica o 2 para el hidrógeno).
Entre sus grandes éxitos está el predecir la fuerza del enlace en las moléculas sencillas. En moléculas como H\(_2\) o F\(_2\), que comparten un par de electrones, el enlace se dice sencillo y es más débil que en moléculas que comparten dos pares, como el O\(_2\), donde el enlace es doble, y todavía más débiles que cuando se comparten 3 pares como en la molécula de nitrógeno, \(N_2\) (enlace triple).
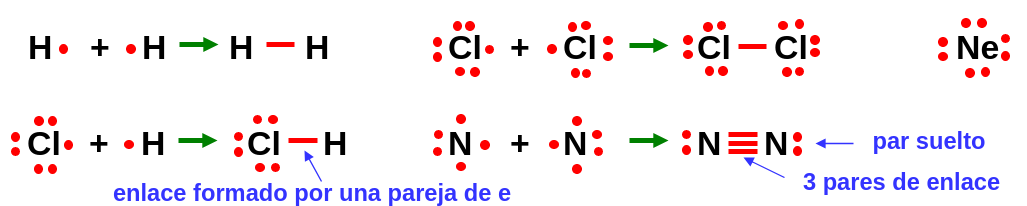
Fig. 4 Ejemplos de la formación de enlaces según el modelo de Lewis. Los átomos se representan por sus distintos símbolos y los electrones de su capa de valencia mediante pequeños círculos rojos. Cada enlace formado por un par de electrones se muestra mediante una raya roja. ```#
Hay varios casos especiales, como aquellos donde se pueden formar varias estructuras equivalentes, donde se dice que existe una resonancia que favorece un enlace algo más fuerte. Estas estructuras se caracterizan por tener enlaces deslocalizados.
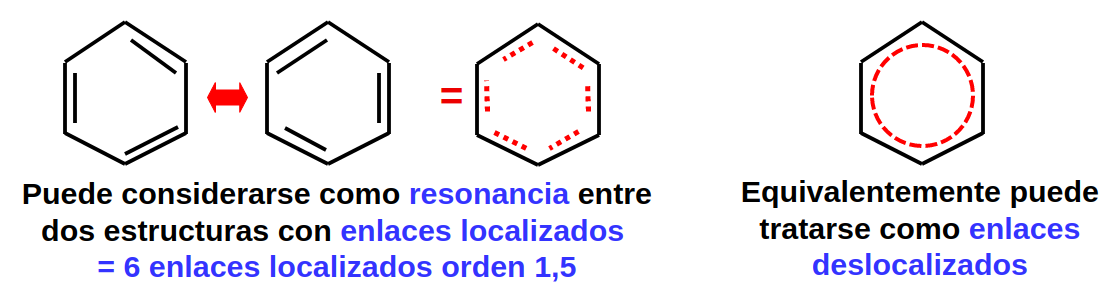
Fig. 5 Ilustración del enlace deslocalizado en el benceno, donde existen dos posibilidades equivalentes de colocar los pares de Lewis en la estructura de la molécula.#
Aún así, el modelo fue bastante criticado debido a que entraba en conflicto con los modelos electrostáticos cuánticos como el de Bohr donde era inesplicable que dos electrones formaran una pareja (dado que los electrones se repelen). Además se encontraron otros problemas como:
La regla del octeto no se verifica en muchos compuestos como las moléculas hipervalentes como PF\(_5\), SF\(_6\), etc. o muchos complejos de metales de transición.
No explica el papel exacto de las parejas de electrones, que como veremos permiten la atracción entre los núcleos atómicos y no considera el espín, que es parte clave del enlace.
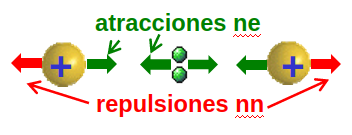
Fig. 6 Como veremos el papel que juegan los pares de electrones tiene mucho que ver con situarse entre los núcleos para que los núcleos se vean atraídos a esa zona central cargada negativamente y se forme un enlace entre los átomos.#
